Der Einfluss von Sport auf das Immunsystem
Siehe auch: Vorlesung "Sport und Immunologie" an der ETH Zürich
Erschienen in der Neuen Zürcher Zeitung, Beilage Forschung und Technik. 23. Oktober 1991, Seite 69.
Ausgangslage
Der bekannte Immunologe und Lehrbuchautor Ivan Roitt kommt in seinem Lehrbuch Immunologie zum Schluss, dass intensive körperliche Betätigung zu einer Schwächung des Immunsystems und damit zu einer erhöhten Anfälligkeit für Infektionen führt. Welches sind die wissenschaftlichen Grundlagen dieser provokativen Feststellung, und ist diese Schlussfolgerung tatsächlich berechtigt? Mit Zunahme der sportlichen Aktivität in unserer "Freizeitgesellschaft" ist es von Interesse, diesen Fragen nachzugehen.Eindeutig negative Folgen?
Roitt warnt aufgrund seiner Überlegungen die Sportenthusiasten drastisch: "Maniacal joggers and other such like masochists - you have been warned"! Tatsächlich scheinen seine Befürchtungen durch den Leistungssport bestätigt zu werden. Seit dem krankheitsbedingten Ausfall Sebastian Coes und anderer Spitzenathleten an den Olympischen Spielen in Seoul ist das möglicherweise geschwächte Immunsystem von Leistungssportlern unter Fachleuten zu einem Diskussionsthema geworden. Für viele Trainer und Sportärzte ist die Infektanfälligkeit von Spitzenathleten und -athletinnen ein Problem. Demgegenüber schreibt der Volksmund dem Sport eine abhärtende, vorbeugende Wirkung zu. Wer hat nun recht? Die moderne Laboranalytik ermöglicht es, den Zusammenhang zwischen sportlicher Leistung und einer grossen Anzahl von immunologischen Messwerten in Blutanalysen zu studieren. Auswirkungen von sportlichem Stress auf diese Messwerte sind inzwischen wissenschaftlich belegt worden. Noch offen allerdings ist die Frage, ob die veränderten Messwerte tatsächlich eine erhöhte Krankheitsanfälligkeit bedeuten.Aufgaben und Funktion des Immunsystems
Die Immunologie ist die Wissenschaft von den biologischen und biochemischen Grundlagen der Abwehrmechanismen des menschlichen Organismus, die beim Eindringen von Krankheitserregern und Giftstoffen in Aktion treten. inaktivieren, die Fähigkeit von im Blut gelösten Stoffen, eingedrungene fremde Zellen zu markieren und evtl. bereits unschädlich zu machen (Komplement, Opsonine) und die Fähigkeit spezialisierter "Fresszellen" (Makrophagen und Granulozyten in Gewebe und Blut) Bakterien, Pilze und Viren aufzunehmen und zu vernichten und dabei weitere Zellen des Immunsystems, die Lymphozyten, durch Signalstoffe anzulocken.Lymphozyten durchlaufen einen Reifungsprozess, in dem sie lernen, zwischen Freund und Feind zu unterscheiden. Nach diesem Reifungsprozess, als immunkompetente Zellen, können sie dann Zelloberflächen (virusinfizierte oder entartete Körperzellen) und Moleküle (z.B. Toxine) anhand des molekularen Reliefs als körperfremd erkennen. Die als körperfremd erkannten molekularen Strukturen werden als Antigene bezeichnet. Im Unterschied zu den Makrophagen sind Lymphozyten in der Lage, nach einer Infektion ein immunologisches Gedächtnis für ein bestimmtes Antigen während Jahren oder lebenslang zu bewahren. Bei weiteren Kontakten mit dem gleichen oder einem sehr ähnlichen Krankheitserreger oder Toxin läuft darum die Aktivierung der Abwehr viel rascher und effizienter an als zuvor. Auf diesem Mechanismus beruht der Erfolg der Schutzimpfungen. Diese erworbene Immunität wird auch spezifisch oder adaptiv genannt. Die spezifische Abwehr stützt sich hauptsächlich auf zwei Hauptgruppen von Lymphozyten, die T-Zellen, welche gegen zellgebundene Antigene reagieren (zelluläre Abwehr), und die B- Zellen welche Antikörper (Immunglobuline) produzieren. Fortschritte in der modernen Zellbiologie erlauben es, die T-Zellen nach ihrer Aufgabe und Funktion weiter in Untergruppen (Subpopulationen) zu unterteilen.
Vereinfachter Ablauf einer Infektabwehr
Zum Verständnis einer Immunreaktion wird in Figur 1 der Ablauf einer Infektabwehr schematisch gezeigt.Figur 1. Schematischer, vereinfachter Ablauf einer Infektion und der dadurch ausgelösten Immunreaktionen. Die Veränderungen nach intensiver Muskelarbeit betreffen nur die akute-Phase-Reaktion, d.h. die Abwehrreaktionen bis und mit Antigenpräsentation und Produktion von Cytokinen durch die Makrophagen. Die nachfolgende Aktivierung der Lymphozyten wird durch den Anstieg der Stresshormone gehemmt.
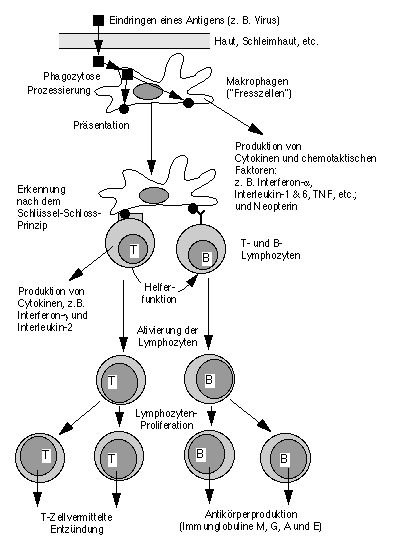
Eingedrungene Antigene werden durch Makrophagen verschlungen, verarbeitet und patroullierenden Lymphozyten zur Erkennung an der Zelloberfläche präsentiert. Makrophagen und verwandte Fresszellen kommen überall im Blut und Gewebe vor, z.B. in den Lungenbläschen, in der Haut, den Schleimhäuten, aber auch in inneren Organen wie der Leber und dem Gehirn. Mit der Aufnahme der Antigene (Phagozytose) und deren Verarbeitung (Prozessierung) beginnen die Makrophagen mit der Produktion einer Reihe Stoffen (u.a. die sog. Lympho- oder Cytokine), welche eine Signalwirkung auf andere Körperzellen und damit auch die Lymphozyten ausüben: Interferon-a, Interleukin-1 und 6, Tumornekrosefaktor (TNF-a), etc. Die Makrophagen erhöhen mit der Phagozytose und Prozessierung der Antigene ihre Stoffwechselrate, was im Blut durch den Anstieg eines typischen Makrophagen-Stoffwechselproduktes, des Neopterins, gemessen werden kann. Bakterien und Viren lösen im Gewebe einen Entzündungsvorgang aus, welcher ebenfalls durch den Anstieg einer Reihe von Entzündungsleitstoffen (z.B. CRP) im Blut gekennzeichnet ist. Diese initialen Vorgänge der Immunabwehr werden unter dem Begriff akute Phase zusammengefasst. Der Erkennungsprozess des prozessierten und auf der Makrophagenoberfläche präsentierten Antigens durch die T- und B-Lymphozyten basiert auf dem Schlüssel-Schloss Prinzip. Nur bei Lymphozyten, bei denen das Antigen (der Schlüssel) in den Rezeptor (das Schloss) passt, wird die Zellvermehrung (Proliferation) ausgelöst. Für die Aktivierung der T-Lymphozyten ist Interleukin-1 und der direkte Kontakt mit dem präsentierten Antigen durch die Phagozyten Bedingung. Die auf der Makrophagenoberfläche vorgezeigten Antigene können nur erkannt werden in enger Verbindung mit den körpereigenen Transplantationsantigenen (MHC Klasse II, in Figur 1 der Einfachheit weggelassen). Aktivierte T-Zellen produzieren Interleukin-2 und Interferon-g, welche die T-Zellen im Sinne einer positiven Rückkoppelung weiter sensibilisieren. Die Aktivierung der B-Lymphozyten ist komplexer. Eine Variante der B-Zellaktivierung stützt sich auf die Antigenpräsentation durch Makrophagen und die Hilfeleistung bestimmter T-Zellen. Ein Überschiessen der adaptiven Immunreaktion wird wie bei einem technischen Regelkreis durch die bremsende Wirkung hemmender T-Lymphozyten gezügelt.
Die Aktivierung der T- und B-Zellen benötigt etwa 1-2 Tage. Sie führt zu einer Zunahme der spezifisch auf das Antigen reagierenden T-Zellpopulation, welche befallene Körperzellen zerstören, und einer B-Zellpopulation, welche spezifisch gegen das Antigen gerichtete Immunglobuline M und später G produziert. Nach erfolgreicher Elimination des Krankheitserregers oder Toxins aus dem Körper bleiben eine Anzahl auf das Antigen spezialisierter T- und B-Zellen als immunologisches Gedächtnis während Jahren und Jahrzehnten erhalten und garantieren die Immunität.
Differenzierte Immunreaktion nach starken Belastungen
Die in Figur 1 dargestellten Stufen und Prozesse bei der Aktivierung des Immunsystems sind heute messbar. Einige Parameter können direkt im Blut gemessen werden, so z.B. die Zahl der weissen Blutkörperchen inklusive aller Lymphozytensubpopulationen. Ebenfalls leicht zugänglich für eine Messung sind die Blutkonzentrationen der Entzündungsleitstoffe, der Immunglobuline und der Cytokine, sowie weiterer Faktoren des Immunsystems (z.B. Komplementsystem). Die Funktionsfähigkeit von Makrophagen und Lymphozyten kann nach der Isolation der Zellen aus dem Blut in in vitro Tests geprüft werden. Somit ist es möglich zu studieren, welche Funktionen der Immunabwehr durch akuten physischen Stress aktiviert und welche nicht betroffen oder gar gehemmt werden. Tabelle 1 zeigt eine Zusammenfassung der bis heute bekannten Resultate, welche z.T. noch einer Nachprüfung bedürfen.Tabelle 1. Veränderungen immunologischer Messwerte unmittelbar nach intensiver Muskelarbeit von 30 - 60 Min. Dauer gemessen. Die Abweichungen kehren innert Stunden oder Tagen auf ihre Ausgangswerte zurück.
| Leukozytenzahl | Starke Zunahme |
| Lymphozytenzahl | Zunahme |
| T-Zellzahl | keine Änderung oder Abnahme |
| B-Zellzahl | Keine Änderung oder Zunahme |
| Helferzellzahl | keine Änderung oder Abnahme |
| Suppressorzellzahl | Keine Änderung oder Zunahme |
| Funktion der Blutphagozyten | Steigerung |
| Funktion der T-Zellen | Starke Abnahme |
| Funktion der B-Zellen | Starke Abnahme |
| Entzündungsleitstoffe etc. (CRP, TNF, Neopterin) | Starke Zunahme |
| Interleukin-1 Produktion | Zunahme |
| Interleukin-6 Produktion | Zunahme |
| Interleukin-2 Produktion | Abnahme |
| Interferon-g Produktion | Keine Änderung |
| Antikörper, Komplementsystem | Keine wesentlichen Änderungen |
Die Zunahme der Leukozytenzahlen im Blut nach Muskelaktivität ist schon seit 100 Jahren bekannt. Sie wird durch eine Einschwemmung von im Gewebe und an den Gefässwänden sitzenden Zellen in den Blutstrom erklärt und geht innerhalb von Minuten bis Stunden nach Abschluss der Anstrengung auf das Normalmass zurück. Negative Folgen auf die Immunität sind dadurch nicht zu erwarten. Vorübergehende Verschiebungen der Lymphozytenzahlen, sowie der Konzentration von B- und T-Zellen und deren Subpopulationen wurden nach akuter Leistung auch ausserhalb der bekannten Normbereichen beobachtet (Tabelle 1). Da sich aber nur 1-2% der gesamthaft im Körper vorhandenen Lymphozyten in der Blutbahn befinden - der Rest der Zellen sitzt in Gewebedepots wie Lymphknoten und Milz, aber auch im übrigen Körpergewebe, durch welches sie dauernd auf der Suche nach Antigenen patroullieren - können diese kurzfristigen, reversiblen Änderungen ebenfalls durch eine Verschiebung von Lymphozyten zwischen dem Gewebe und dem Blut erklärt werden. Für die Beurteilung der Funktion von Phagozyten und Lymphozyten sind die aufwendigeren Zellfunktionstests darum aussagekräftiger.
Die in vitro Funktionsprüfungen von isolierten Blutphagozyten und Lymphozyten - eine in vivo Prüfung ist nicht möglich - haben eine deutliche Funktionssteigerung bei den Phagozyten und eine ebenso deutliche Hemmung der T- und B-Zellfunktion gezeigt.
Messungen von Entzündungsleitstoffen und Cytokinen lassen ebenfalls auf eine Initialisierung der Immunreaktionen, d.h. der akuten Phase, durch intensive Muskelarbeit schliessen. Die Plasmakonzentration sämtlicher auf dieser ersten Stufe beteiligten Signalstoffe nahmen in praktisch allen Studien zu. Sportliche Betätigung löst also genau die gleichen Immunprozesse aus, wie sie bei Beginn einer Infektionskrankheit beobachtet werden können. Hingegen bleibt bei physischem Stress die Blutkonzentration oder die Produktion von Cytokinen in isolierten Lymphozyten, welche eine Aktivierung des spezifischen, adaptiven Immunsystems anzeigen würden, konstant, oder sie nimmt sogar ab.
Mikroläsionen als Auslöser?
Diese Ergebnisse deuten darauf hin, dass Trainingseinheiten und Wettkämpfe eine Immunreaktion einleiten, ohne die spezifische Immunabwehr der Lymphozyten wachzurütteln. Welches sind die Ursachen dieser differenzierten Immunantwort? Es ist bekannt, dass intensive sportliche Leistung zu winzigen (reversiblen) Verletzungen im Bewegungsapparat führen, vor allem in den Muskeln. Die Zerstörung von Muskelzellen durch Training und Wettkampf lässt sich im Blut durch den Anstieg von Muskelenzymen und in histologischen Präparaten durch die Einwanderung von Phagozyten in die betroffenen Areale nachweisen. Offenbar erkennt das Immunsystem die defekten Muskelzellen als fremd, und es wird ein Entzündungsprozess eingeleitet, der sich nach sehr starker Beanspruchung als Muskelkater unangenehm bemerkbar macht. Die Phagozyten leisten hier Aufräumarbeit, um für eine Regeneration Platz zu schaffen.Es ist klar, dass eine Aktivierung des erworbenen Immunsystems nur Verschwendung wäre, da dieses für die Aufräumarbeit des geschädigten Gewebes gar nicht benötigt wird. Die "höheren" Immunprozesse werden offensichtlich gezielt gehemmt.
Immundämpfende Wirkung durch Stresshormone
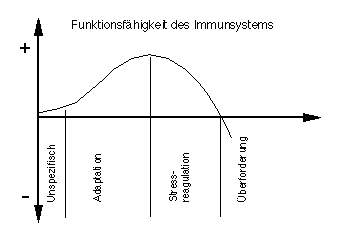
Körperliche Aktivität führt zu einem Anstieg von Stresshormonen, zu denen unter anderen Cortisol und Adrenalin gehören. Es ist seit langem bekannt, dass die Funktion von Lymphozyten durch Stresshormone gehemmt oder sogar ganz unterdrückt werden kann - Cortisolderivate werden in der Therapie denn auch als Entzündungshemmer eingesetzt. Lymphozyten besitzen auf ihrer Oberfläche Antennen (Rezeptoren) mit denen sich die Zelle ein Bild über den Stresszustand des Körpers verschafft. Obwohl Entzündungsleitstoffe und Cytokine eigentlich eine Immunreaktion in die Wege leiten, wird die Aktivierung der Lymphozyten durch den Anstieg der Stresshormone unterdrückt. Der Anstieg der Stresshormone infolge starker körperlicher Belastungen kann als differenzierte Zügelung des spezifischen, adaptiven Immunsystems verstanden werden. Hingegen wird die nützliche Aufräumarbeit der Phagozyten nicht beeinträchtigt. Es ist daher anzunehmen, dass dem Immunsystem durch gelegentlichen physischen Stress keine Nachteile erwachsen, besonders dann, wenn dem Körper genügend Erholungszeit gegönnt wird. Solche Immunprozesse haben kaum negative Folgen für die Immunität des Körpers, im Gegenteil ist es möglich, dass das Phagozytosesystem durch mässig betriebenen Sport trainiert werden könnte. Wie steht es aber mit Hochleistungssportlern, die täglich ein- bis zweimal trainieren, und öfters Wettkämpfe zu bestehen haben? Könnte der dauernde psychische und physische Druck durch Training und Wettkampf schliesslich nicht die Wiederherstellungsfähigkeit überfordern?Um diese Frage zu beantworten, müssen bei Sportlern nicht die Leistungswerte unmittelbar nach Training oder Wettkampf untersucht werden, sondern die sog. Ruhewerte. Bei häufig trainierenden Sportlern (z.B. bei Läufern bereits ab 50 - 70 Laufkilometern pro Woche) wurde gefunden, dass die Lymphozytenzahlen und die Konzentrationen an Immunglobulinen G (besonders die Subklasse II) gegen die unteren Normgrenzen verschoben waren. Ausserdem wurde bei Ausdauersportlern im Speichel ein Mangel an Immunglobulinen A festgestellt. Diese Befunde beweisen für sich allein noch keine erhöhte Infektanfälligkeit durch Leistungssport, sie bilden aber einen wichtigen Hinweis, dass die Befürchtungen nicht aus der Luft gegriffen sind. Es besteht die Möglichkeit, dass bei stark belasteten Sportlern und Sportlerinnen (auch auf Freizeit- und Clubniveau) das spezifische, adaptive Immunsystem über die Stresshormone täglich während mehrerer Stunden gehemmt ist. Im Falle einer Infektion wäre die lahmgelegte Immunabwehr überfordert, die Krankheit könnte somit mit viel grösserer Wahrscheinlichkeit zum Ausbruch kommen (Figur 2).
Figur 2. Die beobachteten Veränderungen der immunologischen Messwerte bei Sportreibenden lassen vermuten, dass die Funktionsfähgkeit des Immunsystems vom Belastungsgrad abhängt